Впервые группе южнокорейских исследователей удалось проследить и задокументировать катализ важного для организма человека фермента. Ученые получили структурные данные на каждом этапе реакции и реконструировали их хронологически, получив молекулярный «фильм», раскрывающий детали сложного многоступенчатого химического процесса.
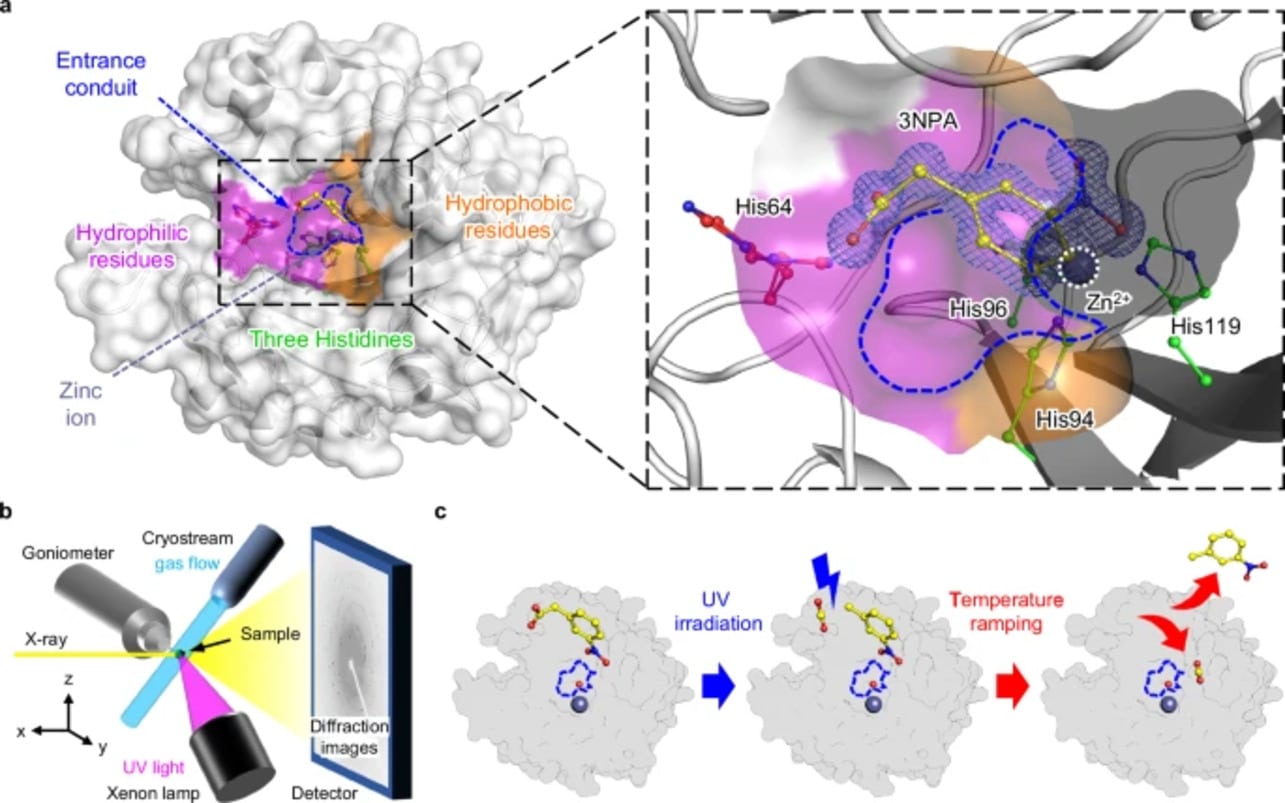
В рамках исследования роли молекул воды физики использовали новейшую технологию. ферментативном катализе Карбоангидразы — это в основном цинксодержащий металлофермент, распространенный у человека, животных, фотосинтезирующих организмов и некоторых нефотосинтезирующих бактерий. Класс карбоангидраз регулирует уровень углекислого газа (CO2) в организме и считается одним из самых каталитически эффективных известных ферментов.
Изучая динамические особенности ферментов, учёные неоднократно подчёркивали их тесную связь с конформационными превращениями — изменением формы макромолекулы, которое часто вызывается факторами внешней среды, и движением молекул воды внутри и вокруг активного центра фермента.
Ученые из Ульсанского национального института науки и технологий (Южная Корея) считают воду неотъемлемой и активной частью ферментного центра. Молекулы воды, по их мнению, важны для стабильности, структуры и динамики ферментов. Также молекулы воды играют значительную роль в катализе и молекулярном распознавании ферментов.
Мало известно о связи структуры и динамики воды с ферментативными механизмами, такими как связывание субстрата, стабилизация переходного состояния и высвобождение продукта. Из-за быстрого темпа промежуточных этапов детальное изучение ферментативных реакций затруднено. Например, карбоангидраза преобразует углекислый газ (CO2) в ионы бикарбоната (HCO3), растворяемые в крови, со скоростью более одного миллиона раз за секунду.
Авторы исследования кинетически захватили каталитические промежуточные продукты от связывания CO2 до высвобождения бикарбоната за временные отрезки короче одной наносекунды. Для этого использовали технику ультрафиолетового фотолиза, то есть разрушения молекул под действием ультрафиолетового излучения, и рентгеноструктурный анализ кристаллов при различных температурах. Фермент сначала охлаждали до -183 градусов Цельсия, затем вводили светочувствительный субстрат (3NPA), который поставлял углекислый газ в активный центр фермента под воздействием ультрафиолета. Потом температуру постепенно увеличивали до -73 градусов Цельсия, фиксируя структурные изменения на каждом этапе.
Первый молекулярный фильм демонстрирует, как перегруппировка и замена молекул воды в активном центре фермента определяют скорость высвобождения продукта, например, бикарбоната. Авторы статьи подчеркивают, что глубокое исследование взаимодействия между ферментами и водой обещает обогатить понимание молекулярной эволюции и дать толчок развитию инновационного дизайна лекарств и инженерии биокатализаторов.
Научная работа опубликована в журнале Nature Communications.