Исследователи выявили новое пептидное соединение, способное подавлять активность MYC — особо сложного белка, нарушение регуляции которого является причиной 75% раковых заболеваний человека. В частности, этот белок не имеет четко определенной молекулярной структуры, что долгое время препятствовало разработке лигандов, способных связываться с ним и оказывать терапевтический эффект. В конечном итоге новое соединение может быть направлено на борьбу с многочисленными формами рака.
Белок MYC — важнейший транскрипционный фактор, нарушение регуляции которого связано с большинством видов рака человека. Хотя его активность обычно строго контролируется, он сверхэкспрессируется в раковых клетках и вызывает их неконтролируемую пролиферацию. «MYC — это не столько пища для раковых клеток, сколько стероид, способствующий быстрому росту рака«, — объясняет Мин Сюэ, профессор Калифорнийского университета в Риверсайде (UCR), в пресс-релизе. «Именно поэтому MYC ответственен за 75 % всех случаев рака у человека«, — добавляет он.
Хотя точный механизм его действия до сих пор обсуждается, этот белок является одной из наиболее изученных фармакологических мишеней в онкологии. Однако поиск подходящего лекарственного лиганда, который бы связывался с ним, представляет собой настоящую проблему. В отличие от большинства белков, MYC не имеет четко определенной структуры. «По сути, это случайный мир«, — говорит Сюэ.
Разработка новых лекарств в основном основывается на нацеливании на четко определенные белковые структуры с помощью процесса, известного как стыковка белка и лиганда. При этом перебираются миллионы (или даже миллиарды) структур, чтобы определить, какая из них достаточно эффективно связывается со своей мишенью, изменяя ее активность и вызывая терапевтический эффект.
Однако «несмотря на десятилетия исследований, MYC остается «нелекарственной» мишенью, не имеющей клинически жизнеспособных терапевтических средств«, — пишут Сюэ и коллеги в своем новом исследовании, опубликованном в . Чтобы преодолеть эти трудности, специалисты изучили новую методику, которая позволила выявить новый пептидный лиганд, способный распознавать MYC с беспрецедентной надежностью.
Сила связывания, близкая к силе антитела
Хотя неупорядоченная структура MYC долгое время препятствовала определению мест стыковки для потенциальных лигандов, различные молекулы ранее исследовались на предмет их способности связываться с определенными участками белка. Однако до сих пор ни одна из них не показала достаточного сродства, чтобы вызвать значительное ингибирование. С другой стороны, белок выполняет свою функцию в ядре, которое недоступно для крупных молекул, таких как антитела. Поэтому исследования должны быть сосредоточены исключительно на малых молекулах, таких как пептиды.
В предыдущем исследовании специалисты из Калифорнийского университета обнаружили, что изменение жесткости и формы пептидного лиганда повышает его способность взаимодействовать с мишенями, не имеющими определенной структуры, такими как MYC. «Пептиды могут принимать различные формы и положения«, — объясняет Сюэ. «Как только вы согнете их и соедините в кольца [у цели], они не смогут принять какую-либо другую форму. Тогда у них низкий уровень случайности«, — добавляет он. Это улучшает их близость к цели.
Основываясь на этих результатах, исследователи использовали метод, называемый метатезисом с раскрытием и замыканием кольца (ROM-RCM), в тандеме, чтобы определить свой лиганд. Это сложный процесс полимеризации, который позволяет контролировать структуру и молекулярную массу получаемого полимера. Этот подход позволил идентифицировать NT-B2R, пептид, который может напрямую связываться с MYC с так называемым субмикромолярным сродством, то есть сила связывания которого близка к силе связывания антитела.
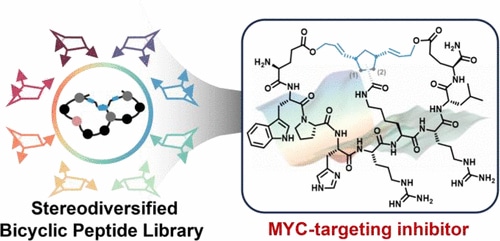
Иными словами, это одновременно очень сильное и высокоспецифичное взаимодействие, на два порядка превосходящее взаимодействие предыдущих лигандов. В опытах in vitro на клетках рака мозга человека NT-B2R успешно подавлял активность MYC, снижая метаболизм и пролиферацию клеток.
Однако для начала доклинических и клинических исследований необходимы дальнейшие усовершенствования. В частности, для доставки пептида в клетки исследователи использовали липидные наночастицы, что не является идеальным вариантом для введения лекарств. Тем не менее открытие лиганда, способного эффективно ингибировать MYC, уже само по себе является достижением. «MYC, по сути, представляет собой хаос, поскольку не имеет структуры. Это, а также его непосредственное влияние на многие виды рака, делает его одним из Святых Граалей в разработке лекарств от рака«, — заключает Сюэ.
