Вирусные инфекции являются одним из основных факторов, способствовавших эволюции первых животных на Земле. Генетический материал этих вирусов, известных как «эндогенные ретровирусы», стал частью генома первых многоклеточных организмов (в результате заражения) и, возможно, даже способствовал Кембрийскому взрыву более 500 миллионов лет назад. Сейчас эта примитивная ДНК составляет 8-10% генома млекопитающих.
До недавнего времени эти вирусные белки считались нежелательной, бесполезной или даже потенциально вредной ДНК. «Интуитивно мы думали, что наличие вирусов в геноме не может быть чем-то хорошим«, — объясняет Серхио Де ла Роса из испанского Национального центра исследований рака (Centro Nacional de Investigaciones Oncológicas, или CNIO) в пресс-релизе.
Однако последние исследования показывают, что этот вирусный генетический материал имеет гораздо более важные функции, чем считалось ранее, например, регулирует определенные гены, которые необходимы для наших биологических функций. В своем новом исследовании, опубликованном в журнале , Де ла Роса и его команда демонстрируют, что эндогенные ретровирусы играют ключевую роль в раннем эмбриональном развитии. Это может иметь важные последствия для регенеративной медицины и создания искусственных эмбрионов (необходимых для изучения нарушений, связанных с беременностью и фертильностью).
Переход от тотипотентного к плюрипотентному состоянию
Начало эмбрионального развития знаменуется превращением оплодотворенной яйцеклетки в тотипотентную зиготу, состоящую из клеток, которые могут дифференцироваться в любую клетку, образующую целый организм. Во время этого перехода происходит обширная замена материнского транскриптома на активацию зиготического генома, а также хорошо организованное эпигенетическое перепрограммирование двух родительских ядер.
На следующем этапе происходит дифференцировка клеток, в результате которой первые две тотипотентные клетки превращаются в четыре плюрипотентные клетки. Эти клетки могут дифференцироваться в любую из специализированных линий, образующих различные ткани, за исключением плацентарной. Однако механизмы, регулирующие этот переход от тотипотентного к плюрипотентному состоянию, до сих пор были во многом непонятны. «Механизмы, контролирующие стабильность факторов плюрипотентности, которые важны для принятия решений о судьбе клеток, еще предстоит выяснить«, — пишут исследователи CNIO в своей статье. Этот переход является критической стадией для эмбрионального развития в целом.
Де ла Роса и его коллеги, возможно, наконец-то разгадали эту загадку, показав, что эндогенный ретровирусный белок под названием MERVL-gag как раз участвует в переходе эмбриональных клеток к плюрипотентности. «Это совершенно новая роль эндогенных ретровирусов«, — говорит соавтор исследования Набиль Джудер (Nabil Djouder) из CNIO. «Мы открыли новый механизм, который объясняет, как эндогенный ретровирус напрямую контролирует факторы плюрипотентности«, — добавляет он.
Симбиотическая коэволюция возрастом несколько сотен миллионов лет
Исследователи ранее обнаружили, что ген под названием URI участвует в эмбриональном развитии. Это белок, который необходим для передачи сигналов о питательных веществах и факторах роста, а также для гомеостаза взрослых органов. Эксперименты на мышах показали, что при его деактивации нарушается постимплантационное развитие эмбрионов.
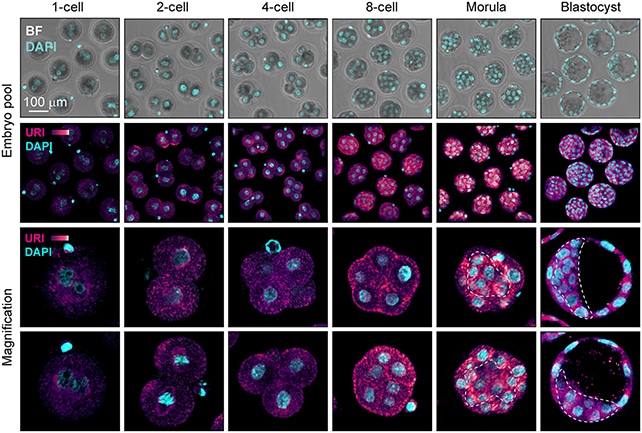
Наблюдения исследователей CNIO согласуются с этими результатами, показывая, в частности, что URI активирует молекулярную передачу сигналов, необходимых для приобретения клеточной плюрипотентности. Если ген деактивирован, эмбриональные клетки остаются в состоянии тотипотентности. Исследуя этот механизм в экспериментах на мышиных эмбрионах, ученые обнаружили, что MERVL-gag модулирует активность URI.
Во время фазы тотипотентности, когда в оплодотворенной яйцеклетке еще только две клетки, экспрессия MERVL-gag особенно высока и подавляет активность URI. Однако постепенно эти уровни меняются на противоположные, так что уровень MERVL-gag снижается, и URI может начать действовать. Плюрипотентность проявляется, когда ооцит содержит четыре клетки, через несколько часов после оплодотворения.
«Переход происходит плавно. Когда экспрессия вирусного белка высока, факторов плюрипотентности становится меньше; когда экспрессия MERVL-gag снижается, URI стабилизирует эти факторы«, — объясняет Де ла Роза. По словам эксперта, это взаимодействие регулируется в очень точные сроки, чтобы дать эмбриону достаточно времени для плавной координации перехода в плюрипотентное состояние. «Наши результаты свидетельствуют о симбиотической коэволюции ERV с клетками-хозяевами, обеспечивающей плавный и быстрый ход раннего развития эмбриона«, — заключают исследователи.
