В связи с растущим значением и использованием стволовых клеток в медицине возможность их безопасного и эффективного производства приобретает решающее значение. Ученые разработали инновационную методику превращения специализированных клеток в стволовые путем стирания их клеточной памяти. Такой подход может повысить качество стволовых клеток, используемых в регенеративной медицине, и сделать терапию более безопасной и эффективной.
Регенеративная медицина, в которой основное внимание уделяется способности организма к самовосстановлению, в значительной степени опирается на использование стволовых клеток. Эти клеточные единицы, обладающие уникальной способностью превращаться в любой тип клеток организма, лежат в основе многих исследований, направленных на лечение заболеваний, ранее считавшихся неизлечимыми.
Недавно исследователи открыли метод перепрограммирования соматических клеток в индуцированные плюрипотентные стволовые клетки, предварительно стерев их клеточную память. Это открытие, ставшее результатом исследования, проведенного под руководством профессора Райана Листера из Института медицинских исследований имени Гарри Перкинса и Университета Западной Австралии и профессора Хосе М Поло из Университета Монаша и Университета Аделаиды, может пересмотреть наш подход к терапии на основе стволовых клеток и возможности их применения. Исследование опубликовано в журнале .
Проблема клеточной памяти
Перепрограммирование соматических клеток — специализированных клеток нашего организма — в индуцированные плюрипотентные стволовые клетки (iPS) — сложная процедура. Она основана на введении специфических факторов транскрипции, в частности OCT4, KLF4, SOX2 и MYC. Эти факторы играют ключевую роль в превращении соматических клеток в iPS, позволяя им приобретать свойства, сходные со свойствами эмбриональных стволовых (ЭС) клеток.
Однако, несмотря на то что iPS и ЭС имеют много общих характеристик, они не идентичны. Несмотря на способность дифференцироваться в различные типы клеток, iPS-клетки демонстрируют эпигенетические и функциональные различия по сравнению с ЭС-клетками. Эпигенетика — это химические модификации ДНК и связанных с ней белков, которые могут влиять на экспрессию генов без изменения самой последовательности ДНК.
Эти различия между iPS и ЭС часто связывают с так называемой «эпигенетической памятью» соматических клеток. Даже после перепрограммирования iPS-клетки могут сохранять определенные эпигенетические метки, оставшиеся от предыдущего состояния соматических клеток. Эта остаточная память может влиять на поведение и характеристики iPS-клеток, делая их несколько отличными от эмбриональных стволовых клеток.
Новая стратегия перепрограммирования
Для преодоления этой проблемы исследователи разработали новый метод, получивший название «наивное переходное перепрограммирование». В основе этой стратегии лежит естественный процесс эпигенетической перезагрузки, происходящий в эмбрионах перед их имплантацией в матку. Имитируя этот процесс, ученые надеются получить перепрограммированные клетки, не только похожие по своим функциям на эмбриональные стволовые клетки, но и лишенные нежелательных эпигенетических меток, связанных с их предыдущим состоянием.
Доктор Сэм Бакберри, специалист по информатике из Института Гарри Перкинса (Harry Perkins Institute, UWA) и Института Telethon Kids, один из ведущих авторов исследования, говорит, что, изучив, как изменяется эпигеном соматических клеток в процессе перепрограммирования, они определили, когда появляются эпигенетические аберрации. Это позволило им ввести новый этап перезагрузки эпигенома, чтобы избежать их и стереть память. Для этого они используют факторы транскрипции вируса Sendai OKSM.
Профессор Хосе Поло (Jose Polo) из Института биомедицинских открытий Монаша и соавтор работы, поясняет в пресс-релизе: «Это значительно уменьшает различия между iPS-клетками и ЭС-клетками и максимально повышает эффективность применения iPS-клеток человека«. Разработанный ими метод позволяет предположить, что остаточная эпигенетическая память не является неизбежным следствием процесса перепрограммирования. Напротив, возможно свести к минимуму или даже устранить эти остаточные эпигенетические метки.
Многообещающие результаты
Новый метод перепрограммирования дал впечатляющие результаты. iPS-клетки, полученные с помощью этого метода, морфологически и молекулярно были похожи на ЭС-клетки. Это означает, что биохимически и генетически эти вновь перепрограммированные iPS-клетки практически неотличимы от ЭС-клеток.
Одним из наиболее примечательных аспектов этого нового метода является его способность исправлять эпигенетические аномалии. Как уже отмечалось ранее, одной из основных проблем iPS-клеток, перепрограммированных традиционными методами, является сохранение остаточных эпигенетических меток, свидетельствующих об их прежнем состоянии соматических клеток. Однако при новом подходе iPS-клетки демонстрируют значительное снижение уровня этих остаточных меток. Другими словами, они подвергаются «эпигенетической коррекции», которая еще больше приближает их к естественному состоянию ЭС-клеток.
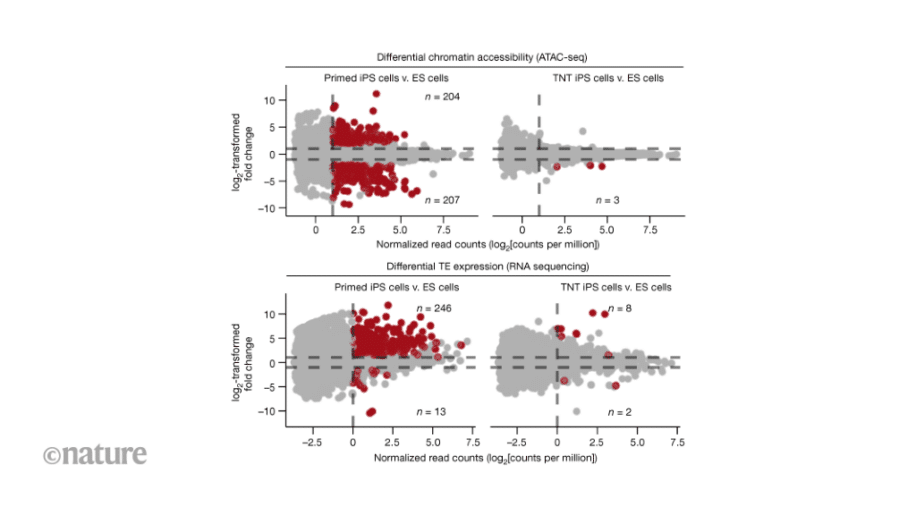
Этот прорыв в области перепрограммирования клеток открывает новые перспективы для регенеративной медицины. iPS-клетки уже играют центральную роль в различных областях медицины. Например, они позволяют воспроизводить в лабораторных условиях конкретные заболевания, чтобы лучше их изучить, проводить предварительные испытания новых лекарств или разрабатывать методы лечения, основанные на трансплантации клеток. Если iPS-клетки удастся получить таким образом, чтобы они были практически идентичны ЭС-клеткам, то их использование может стать более надежным и безопасным, что позволит оптимизировать результаты терапии и исследований на основе этих клеток.
