Созданное соединение лишает патогенных бактерий защиты иммунной системы человека. При этом оно не воздействует на полезные микроорганизмы кишечника, что открывает новые возможности для противостояния устойчивости к антибиотикам.
Устойчивость бактерий к антибиотикам представляет собой серьезную угрозу для здравоохранения во всем мире. По данным Всемирной организации здравоохранения, ежегодно около пяти миллионов человек умирают от инфекций, вызванных устойчивыми бактериями. Специалисты предупреждают о том, что к 2050 году эта проблема может стать главной причиной смертей на Земле.
Антибиотики существенно снизили смертность от инфекционных заболеваний, однако частый и порой необдуманный их прием вызвал возникновение резистентных бактерий. Кроме того, антибиотики обычно воздействуют на критически важные процессы широкого спектра бактерий. Вследствие этого уничтожаются не только патогенные микроорганизмы, но и полезные бактерии, составляющие микробиом человека.
Это нарушает баланс микрофлоры и может вызвать другие проблемы со здоровьем. Поэтому поиск новых мишеней в бактериальных клетках и разработка инновационных противоинфекционных средств — приоритетная научная и медицинская задача. Один из перспективных подходов — лишать бактерии способности вызывать болезнь или приобретать устойчивость, не убивая их напрямую.
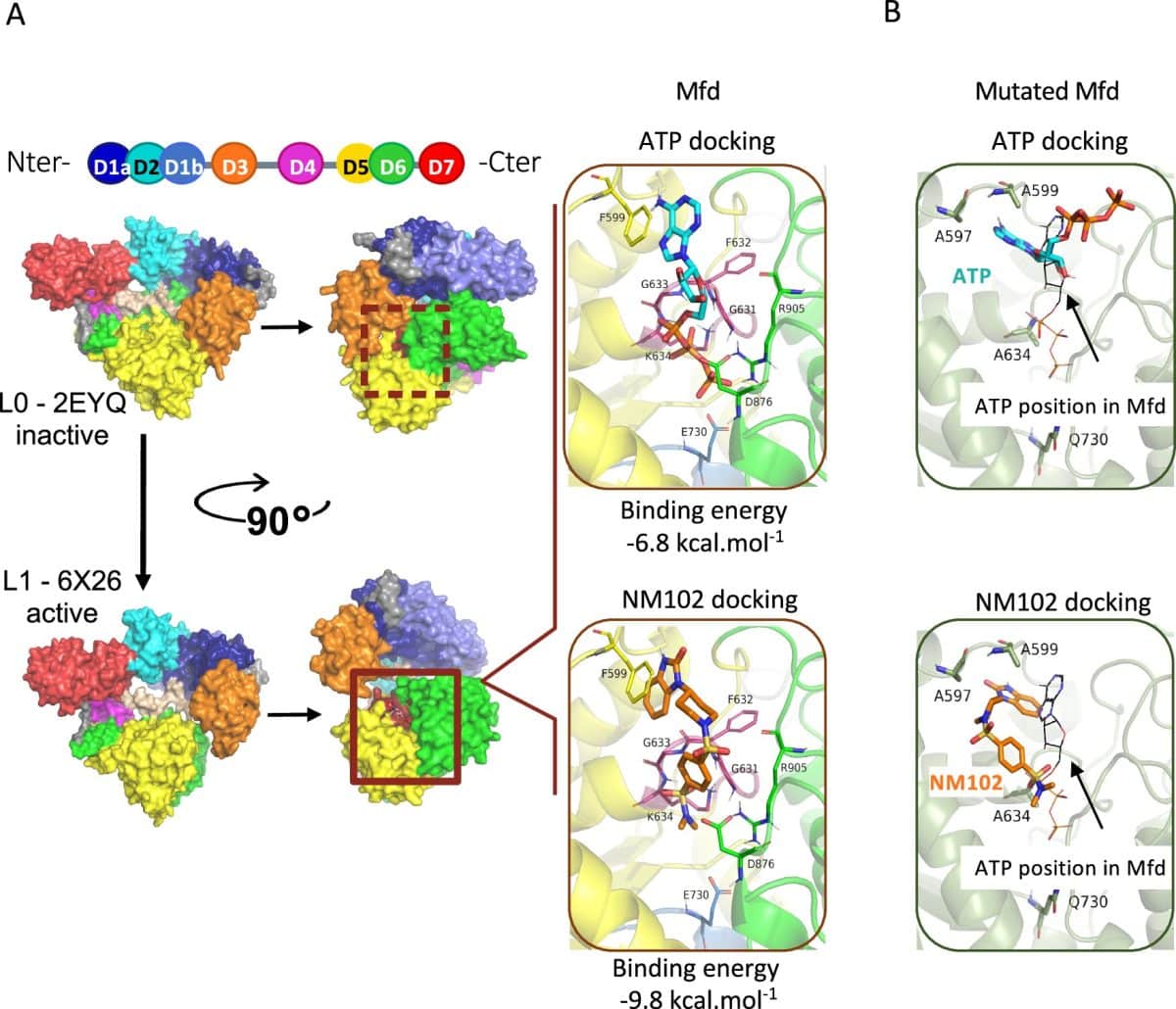
Международный консорциум учёных изучает белок Mfd (Mutation Frequency Decline). Белок присутствует у многих бактерий, но отсутствует у человека и животных. Mfd помогает патогенам противостоять иммунной системе хозяина. Появляющиеся из-за этого белка случайные мутации повышают способность бактерий развивать устойчивость к лекарствам. Это делает Mfd привлекательной мишенью для новых препаратов.
Ученые стремились обнаружить вещество, препятствующее работе Mfd. С помощью компьютерного моделирования изучили библиотеку из почти пяти миллионов молекул, чтобы определить их способность связываться с активным центром Mfd — местом присоединения к белку молекулы АТФ, использующейся для энергии Mfd. Виртуальный скрининг выявил 95 потенциальных кандидатов.
Следующие лабораторные испытания выявили, что молекула NM102 подавляет активность Mfd наиболее эффективно — на 85%. Эксперименты подтвердили, что NM102 связывается с АТФ-связывающим участком белка Mfd и конкурирует с АТФ за это место. Сродство NM102 к Mfd оказалось выше, чем у самой АТФ. Проверка показала специфичное действие NM102 на Mfd без влияния на работу сходных АТФ-зависимых белков человека или других бактериальных белков.
Эффективность NM102 оценили на моделях инфекций, поражавших гусениц шелкопряда. Bombyx eri Молекула проявила антимикробную активность лишь в условиях стресса, имитирующего ответ иммунной системы, например, при воздействии оксида азота NO, который производят иммунные клетки. В отсутствие такого стресса NM102 не влияла на бактерии.
NM102 уменьшал число патогенных бактерий, таких как, в поражённых органах. Klebsiella pneumoniae и Pseudomonas aeruginosa…включая штаммы, устойчивые к антибиотикам. К примеру, у гусениц, инфицированных… P. aeruginosaОбработка NM102 уменьшила количество бактерий приблизительно на триста раз.
Для облегчения введения и улучшения растворимости, молекулу поместили в биоразлагаемые наночастицы из полимера PLGA. Дополнительные испытания на культурах клеток человека и модельных организмов показали отсутствие токсичности для организма.
Результаты, опубликованные в журнале Nature CommunicationsNM102 демонстрирует три ключевых эффекта. Во-первых, молекула не уничтожает бактерии напрямую, а делает их чувствительными к иммунной системе хозяина. Во-вторых, она уменьшает количество патогенов в организме без вреда для полезной микробиоты — анализ состава кишечной микробиоты мышей не выявил значимых изменений после введения NM102.
NM102 препятствует механизму, позволяющему бактериям выработать лекарственную устойчивость. Молекула подавляет способность Mfd ускорять мутации, снижая возникновение у бактерий устойчивости к антибиотикам рифампицину и стрептомицину в лабораторных условиях на восемь и два раза соответственно.
Открытие NM102 представляет собой новый подход к борьбе с инфекциями: вместо прямого уничтожения бактерий предлагается стратегия их «разоружения», которая помогает иммунной системе справиться с патогеном и защищает полезную микробиоту. Способность NM102 снижать вероятность развития лекарственной устойчивости делает ее особенно перспективной.
Ученые запатентовали мишень, белок Mfd, и саму молекулу. Планируется оптимизация NM102 для создания эффективных и безопасных лекарств на её основе.