Тестирование различных способов терапии нейродегенеративных заболеваний возможно либо на модельных животных — генетически модифицированных мышах, — либо на культуре человеческих клеток. В первом случае успех эксперимента вовсе не означает, что препарат окажется безопасен и эффективен для человека. Во втором требуется очень много времени для «созревания» нейронов до состояния, аналогичного возрасту клеток в мозге большинства больных с нейродегенеративными состояниями. Именно эту проблему решает новая модельная клеточная культура, созданная в США.
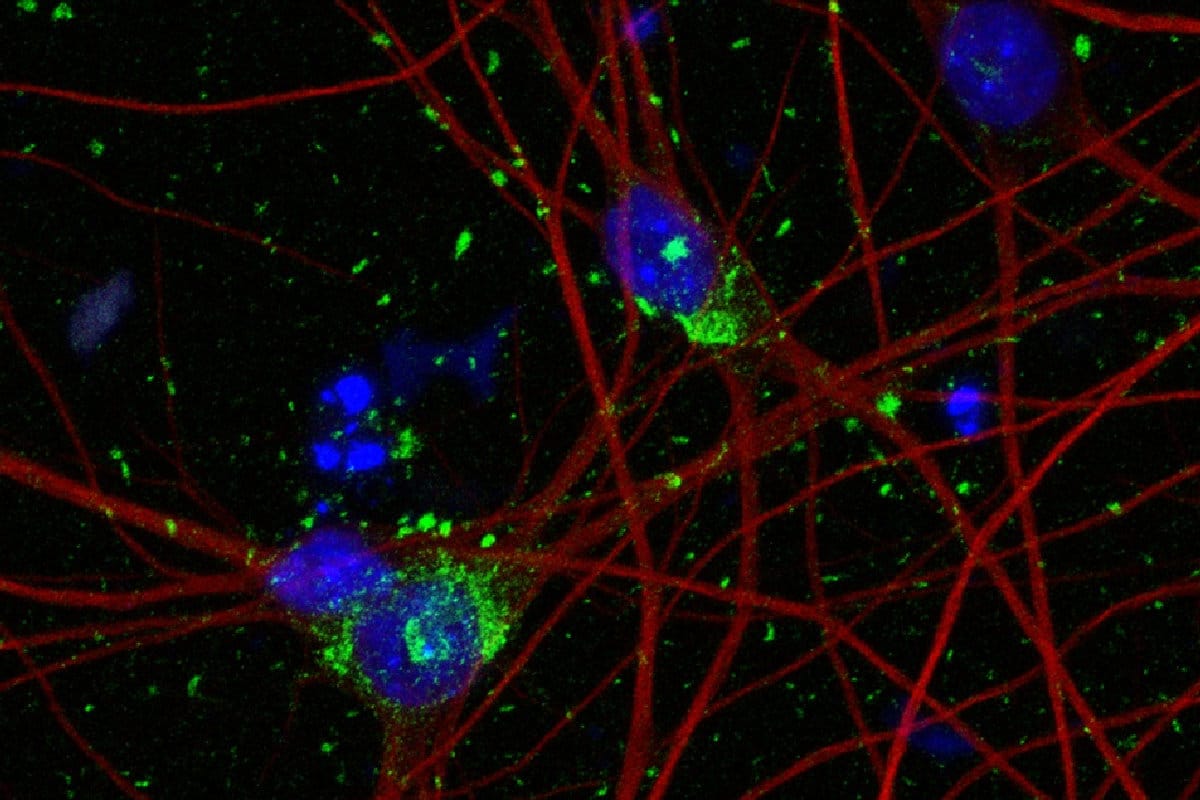
Значительная часть всех нейродегенеративных заболеваний связана с нарушением «нормальной работы» тау-белка (MAPT) — ключевого элемента цитоскелета нейронов. Такие заболевания называются таупатиями. Среди них — болезни Альцгеймера и Пика, прогрессирующий надъядерный парез взора, кортикобазальная дегенерация.
По ряду причин, чаще всего с возрастом, в клетках происходят чрезмерное фосфорилирование тау-белка и его изоформ. В результате MAPT формирует не микротрубочки цитоскелета, а нейрофибриллярные клубки. Эти структуры постепенно нарушают нормальную жизнедеятельность нейронов и наряду с прочими патологическими изменениями, которые зависят от конкретного заболевания, приводят к системной утрате функций нервной системы.
Серьезное препятствие для исследования этих процессов — их медлительность. В модельных организмах и культурах человеческих клеток формирование характерной картины нейродегенеративного заболевания занимает многие месяцы. С мышами такой срок еще можно принять: как-никак, ученые давно привыкли содержать целые выводки подопытных животных в разной степени готовности к экспериментам. Да, это недешево и хлопотно, к тому же результаты не всегда переносятся на людей. Но технология отработана и обладает хорошей результативностью.
А вот клеточную культуру выращивать, контролировать и поддерживать в строго определенных условиях так же долго — целый проект немалой сложности. Особенно когда речь идет о дорогих культурах человеческих стволовых клеток. Зато результаты гораздо ценнее с точки зрения медицины. В общем, идеального решения нет, все они проблемные.
Есть еще одно ограничение: человеческие плюрипотентные стволовые клетки (hiPSC), специализированные в нейроны, производят очень мало 4R-изоформ тау-белка. А для изучения многих тонкостей патологических процессов, связанных с нейродегенеративными заболеваниями они особенно важны. Проще говоря, чтобы найти наиболее действенные методы сдерживания таупатий, нужно культивировать клетки не месяцы, а годы или даже десятилетия — иначе достаточное количество 4R-изоформ в нейронах попросту не накопится. Естественно, такой подход неоправданно сложен и дорог.
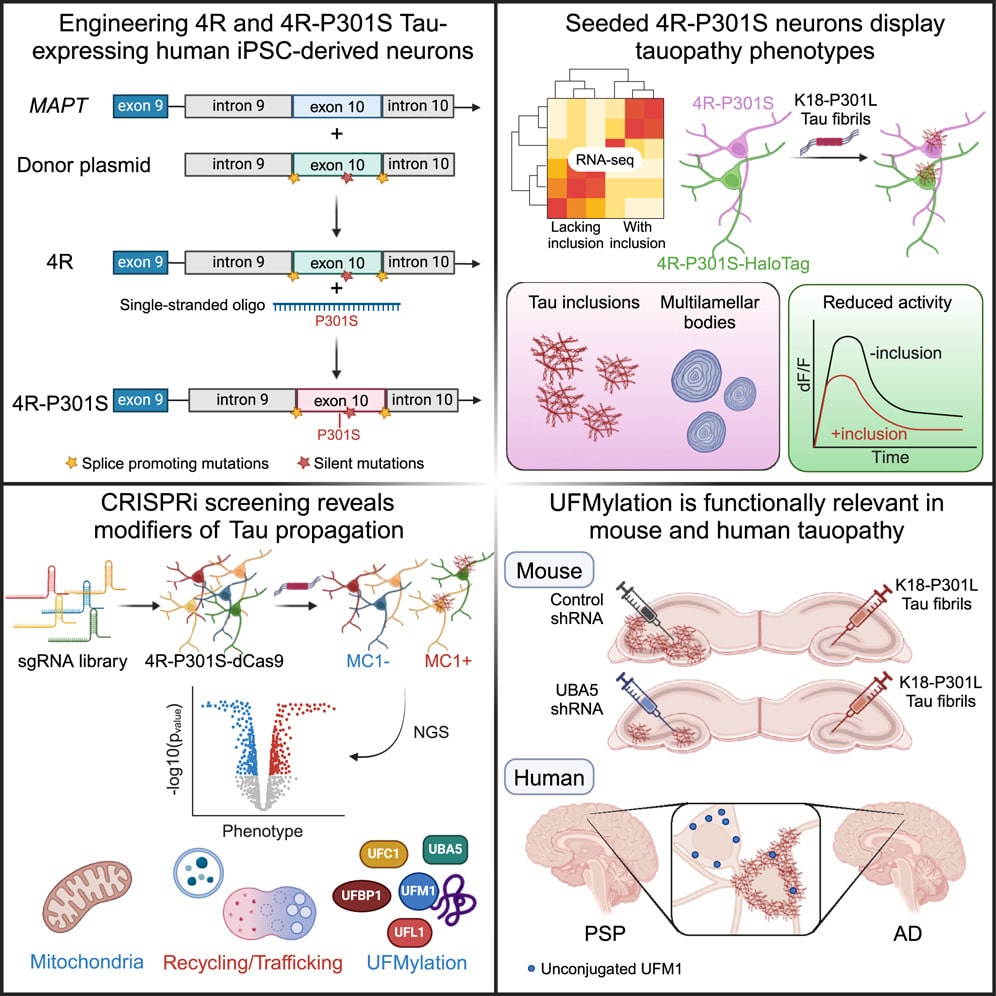
На помощь должна прийти новая клеточная культура, несущая мутацию P301S в гене, отвечающем за выработку тау-белка. Это генетически модифицированные плюрипотентные стволовые клетки человека, специализированные в нейроны, которые вырабатывают повышенное количество MAPT. Они способны накопить необходимые объемы разных изоформ этого белка, включая 4R, за считанные недели.
Чтобы дополнительно улучшить результат, американские исследователи, используя CRISPR-интерференцию (селективное «выключение» генов), провели скрининг тысячи генов и оценили их влияние на производство тау-белка. Всего ученым удалось выделить 500 генов, вносящих вклад в этот процесс.
Одно из перспективных открытий, сделанных в описываемой научной публикации, — роль белка UFM1, а точнее — каскада его взаимодействий с другими молекулами в нейронах. Ранее в мозге погибших пациентов с болезнью Альцгеймера обнаруживались нарушения «работы» UFM1, однако подробнее процесс не изучался. Теперь же ученые наглядно увидели: чтобы затормозить распространение тау-белков по клетке, достаточно заблокировать энзим, необходимый для функционирования UFM1-каскада.
Новую клеточную культуру разработали специалисты из Медицинского колледжа Вейля Корнеллского университета (Weill Cornell Medicine) при участии коллег из ведущих научно-исследовательских и медицинских учреждений США и Канады. Научная работа с описанием методики создания новой клеточной культуры человеческих нейронов и результатами экспериментов по тестированию целей для терапии нейродегенеративных заболеваний опубликована в рецензируемом журнале Cell.
