В Германии учёные обнаружили систему, удаляющую поврежденную митохондриальную ДНК и предотвращающую старение клеток. Белок VPS35 играет ключевую роль, направляя дефектные участки в лизосомы для переработки. Открытие объясняет, как клетки избегают накопления мутаций, вызывающих болезни Паркинсона, Альцгеймера и диабет.
Митохондрии, выполняющие роль энергетических станций клетки, имеют собственную ДНК, которая со временем повреждается из-за окислительного стресса. Накопление дефектов в этой ДНК приводит к нарушениям выработки энергии, ускоряет старение и провоцирует нейродегенеративные заболевания.
Раньше учёные знали, что клетки могут удалять повреждённые митохондрии при помощи аутофагии, но механизмы локального «ремонта» оставались неизвестны. Science Advances, раскрываетКак протекает восстановление повреждённой митохондриальной ДНК.
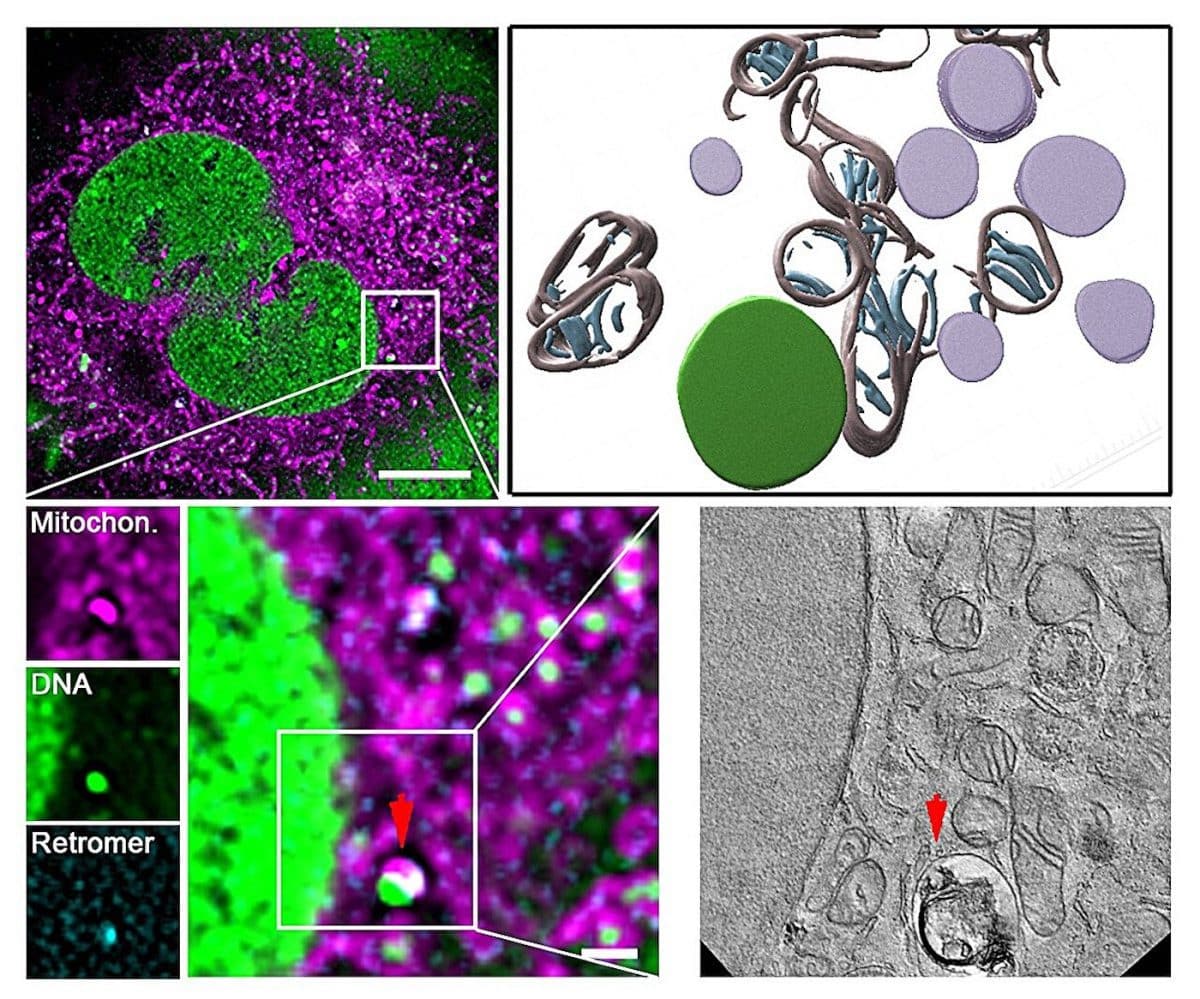
С помощью пространственной протеомики ученые выяснили, что при стрессе митохондрии интенсивно взаимодействуют с лизосомами. В случае искусственного повреждения митохондриальной ДНК мутацией белка… Twinkle Включая ключевой компонент, был активирован белковый комплекс ретромера. VPS35.
Комплекс создает везикулы — крошечные пузырьки, изолирующие поврежденные участки ДНК от здоровых и транспортирующие их в лизосомы. В них ферменты разрушают некачественные гены.
Эксперименты с клетками линии HeLa показали, что подавление VPS35 увеличивает количество поврежденной митохондриальной ДНК на 60%, а активация ускоряет «чистку» в три раза. Ученые подтвердили результаты на плодовых мушках: у насекомых с искусственными мутациями митохондриальной ДНК активация VPS35 восстанавливает функции митохондрий на 80% и устраняет дефекты развития.
Используя методы корреляционной световой и электронной микроскопии CLEMВ ходе исследования ученые продемонстрировали визуальную модель этого процесса: молекула ДНК покидает митохондрии через отверстия, сформированные белком. регулятором апоптоза BAXИ сразу направляется в везикулы, не накапливаясь в цитоплазме.
Обнаружение механизма утилизации митохондриальной ДНК лизосомами раскрывает способ защиты клеток от «за засорением» испорченной ДНК. Регулирование активности ретромера может стать стратегией для предотвращения накопления повреждений в митохондриях и поддержания здоровья клеток.