Японские учёные успешно внедрили гены в организм приматов с помощью невирусного метода. Получились трансгенные макаки-крабоеды с устойчивой работой чужеродных генов во всех тканях.
Биотехнологические исследования на мышах не всегда применимабельны к человеку из-за различий в физиологии. Такие модели часто не воспроизводят сложные человеческие болезни. Приматы, например макаки-крабоеды, генетически близки к людям, но их генетическая модификация до сих пор требует вирусных систем с ограничениями.
В работе с некоторыми вирусами необходимы лаборатории повышенной безопасности. Вирусы вмещают лишь небольшие участки ДНК (до 8-10 тысяч пар оснований) и приводят к случайным мутациям. Отсутствие возможности проверить эффективность модификации перед переносом эмбрионов в матку приводит к рождению животных без нужных генов, что нарушает этические нормы.
Группа японских ученых разработала В журнале опубликована статья о замене вирусных методов на другие. Nature CommunicationsБиологи применили систему piggyBac, функционирующую по-другому, чем вирусная. Система базируется на транспозонах — генетическим элементам, способным перемещаться в пределах генома.
PiggyBac Открытие было сделано в 1980-х годах у насекомых, но позже адаптировали для млекопитающих. Фермент транспозаза — ключевой компонент системы. Он вырезает участок ДНК, окруженный специфическими последовательностями — транспозоном, и встраивает его в новое место. В отличие от вирусов, piggyBac не оставляет следов в геноме после удаления транспозона и может переносить гены длиной до 200 тысяч пар оснований.
Учёные сначала оптимизировали метод на мышах: вводили piggyBac вместе со сперматозоидами в зрелые яйцеклетки. При концентрации вектора 10 нанограммов на микролитр 62% эмбрионов показывали стабильную экспрессию флуоресцентных белков. Все родившиеся мыши (семь из двадцати одного эмбриона) имели встроенные гены, которые передались 72% потомства.
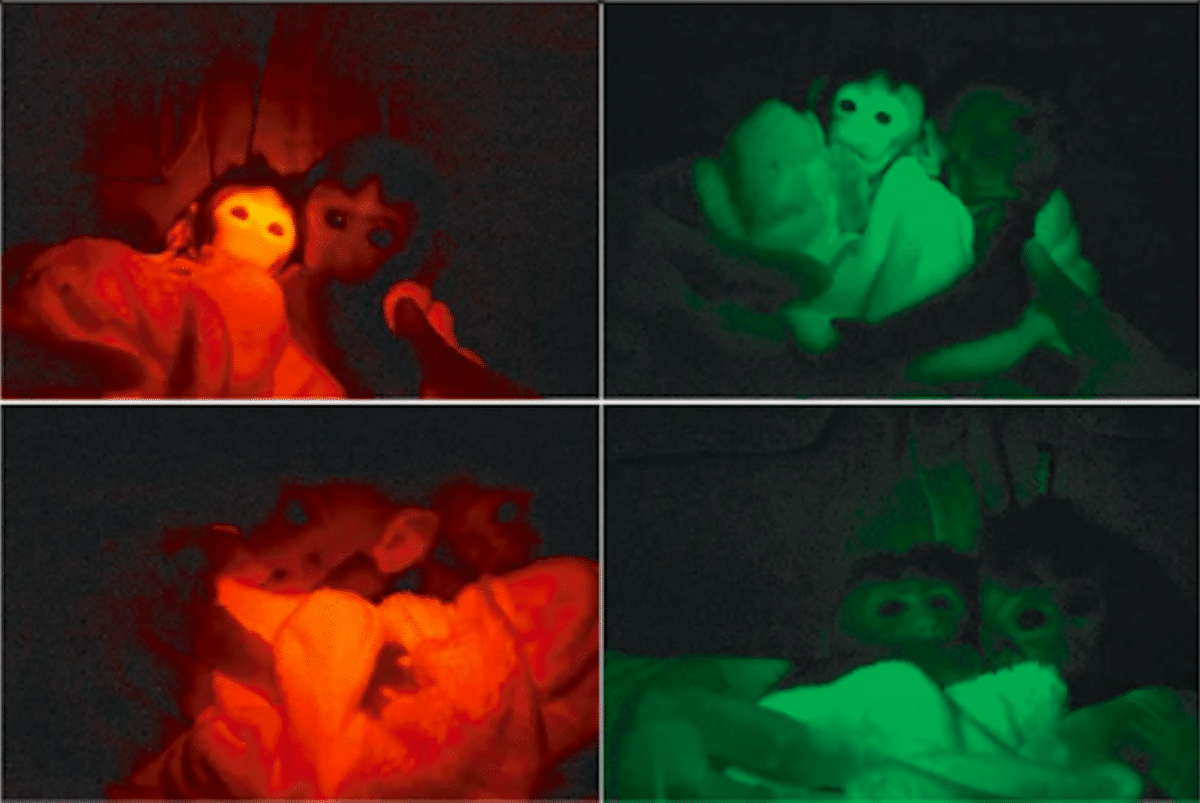
Метод применили к макакам-крабоедам. Из 34 эмбрионов 32 продемонстрировали активность флуоресцентных маркеров. После переноса 20 эмбрионов четырем самкам родились три детеныша. У двух из них красный флуоресцентный белок располагался в мембранах клеток, а зеленый — в ядрах. Экспрессия генов подтвердилась во всех тканях, включая мозг, сердце и половые клетки, варьируясь от 95-100% в сердце и мышцах до 30% в печени и мозге.
Исследование ДНК выявило разную локализацию генов в геноме, но не в ключевых зонах, таких как участки запуска транскрипции. Выжившие обезьяны имели до четырех сайтов интеграции, а погибшие — восемь-девять. Это может свидетельствовать о связи между количеством вставок и выживаемостью.
Новый метод преодолел основные препятствия вирусных методов: опасность заражения, объем генов и отсутствие возможности тестирования эмбрионов на ранних стадиях. Но сложности с мозаицизмом — неравномерным функционированием генов в клетках — всё ещё остаются актуальными.
В будущем биотехнологи стремятся улучшить систему piggyBac для управления временем встройки генов и повышения точности её действия. Это позволит создать приматов с моделями нейродегенеративных, иммунных и других болезней, изучение которых невозможно провести на грызунах.