Даже в компактных геномах вирусов встречаются паразитарные участки — так называемый эгоистичный генетический материал. Как правило, такие последовательности нуклеотидов кодируют только специальные белки для собственной имплантации в геном потомков своего хозяина. Американские микробиологи впервые доказали, что у некоторых бактериофагов такие включения несут важную и полезную функцию: они не только занимаются собственным воспроизводством в дочерней ДНК, но и мешают конкурентам вируса-хозяина размножаться.
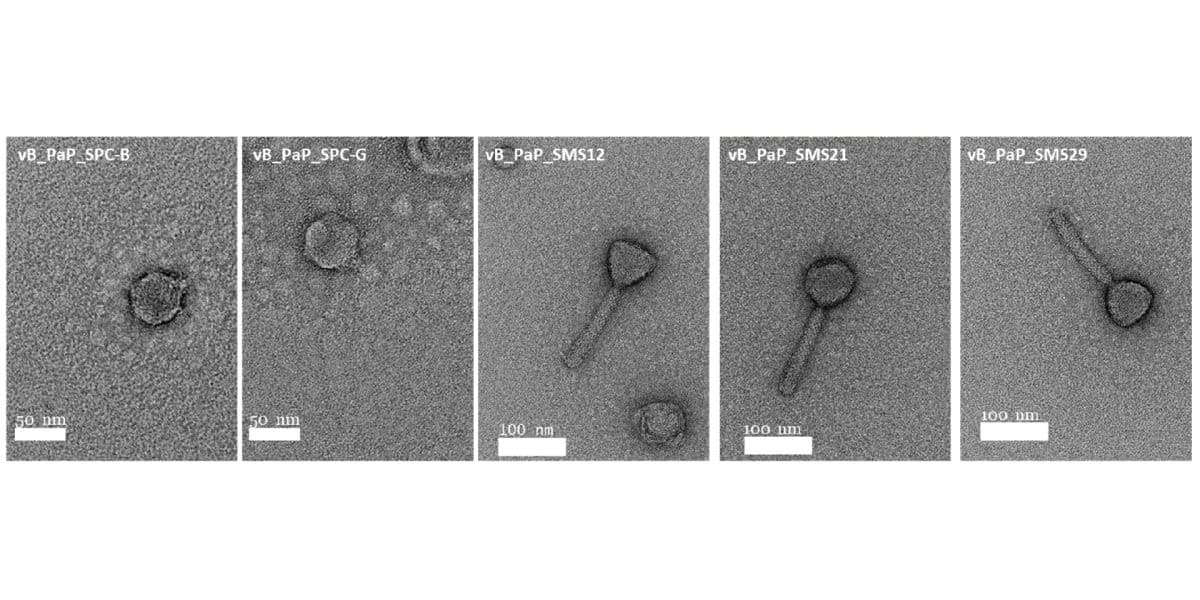
Фаготерапия — перспективное направление лечения антибиотикорезистентных инфекций с помощью вирусов, атакующих бактерии, — бактериофагов. Такая терапия, как правило, проводится не одним фагом, а «коктейлем», состав которого подбирается для достижения максимальной эффективности. Однако эту эффективность порой трудно предсказать из-за недостаточно изученных факторов совместимости разных вирусов в комбинации друг с другом.
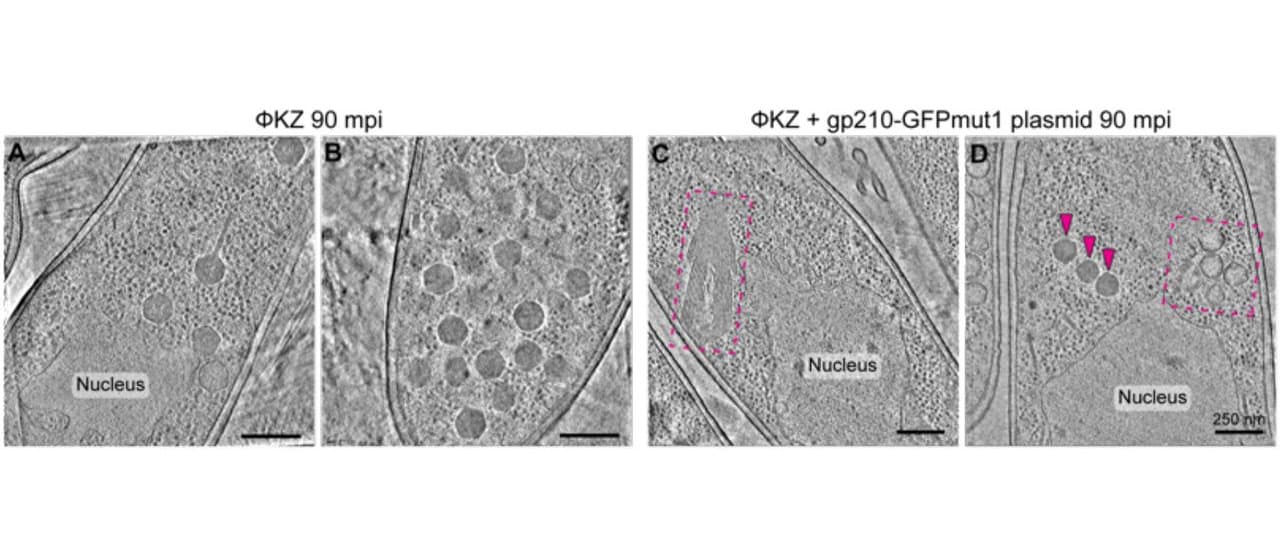
Американские ученые как раз занимались исследованием этой проблемы на примере гигантских бактериофагов ΦPA3 и ΦKZ (джамбо-фаги), применяемых в лечении инфекций, сопутствующих муковисцидозу. Когда они размножались в синегнойной палочке по отдельности, процесс шел с сопоставимой эффективностью для обоих вирусов. Но стоило заразить бактерию двумя фагами одновременно, и капсиды ΦKZ переставали правильно собираться.
Причина оказалась в самонаводящейся эндонуклеазе (homing endonuclease) gp210. Она представляет собой ярчайший пример эгоистичного генетического материала. По крайней мере, пока бактериофаг ΦPA3 размножается в пораженной клетке один.
Эндонуклеазу gp210 кодирует интрон — участок ДНК между экспрессируемыми фрагментами «основного» генома. После кодирования все, что делает эта самонаводящаяся эндонуклеаза, — встраивает в новую ДНК бактериофага ΦPA3 последовательность нуклеотидов, необходимую для кодирования себя же.
Но картина радикально меняется, если бактериофаг ΦPA3 находится в среде, где присутствует его конкурент ΦKZ. Тогда gp210 выполняет не только задачу собственного воспроизводства по привычной схеме, но и «атакует» геном бактериофага-конкурента. Она не может успешно встроить в его геном «свою» последовательность нуклеотидов, но все равно успешно разрезает ДНК в месте, где расположены ключевые для размножения ΦKZ гены.
В результате ΦPA3 получает большое преимущество и быстро вытесняет других бактериофагов из популяции зараженных бактерий.
Новая научная работа показывает направление дальнейших исследований совместимости бактериофагов для терапии. Кроме того, она важна и для понимания эволюции вирусов — очевидно, что «эгоистичный генетический материал» может играть заметную роль в этом непрерывном процессе. Вдобавок открытие американских биологов может быть полезно не только в изучении бактериофагов. Паразитные фрагменты генома присутствуют в ДНК и РНК самых разных организмов.
Исследование с описанием открытия опубликовано в рецензируемом журнале Science, в открытом доступе находится только препринт. Его авторы — сотрудники Калифорнийского университета в Сан-Диего (США).
