Ученые создали наночастицы из оксида церия и пирролохинолинхинона. При рентгеновском облучении эти наночастицы избирательно защищают здоровые клетки от гибели. Наночастицы поддерживают работу антиоксидантных систем нормальных клеток, а у раковых клеток стимулируют выработку активных форм кислорода, что приводит к повреждению клеточных структур. Вероятно, такой эффект связан с разницей в кислотности между раковыми и здоровыми клетками. Эта разработка может уменьшить негативное воздействие лучевой терапии при лечении онкологических заболеваний. поддержанного грантом Российского научного фонда (РНФ), опубликованы в журнале Antioxidants.
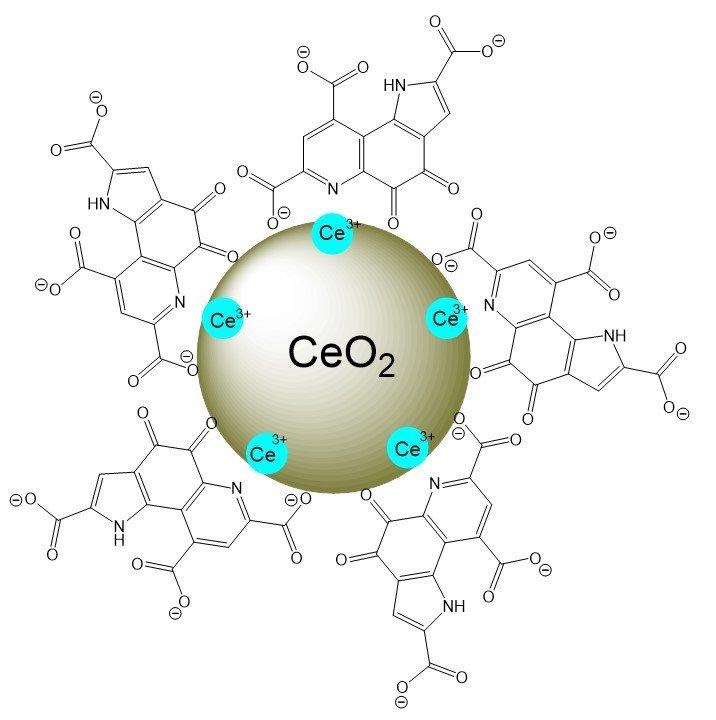
Схема наночастиц церия, измененных пирролохинолинхиноном.
Раковое заболевание лечат с помощью лучевой терапии, при которой опухоль поражается рентгеновским, гамма- или другим ионизирующим излучением. Процесс запускает окислительные процессы, повреждающие ДНК, белки, мембраны и другие структуры, приводя к гибели клеток. Лучевая терапия действует неспецифично — погибают как опухолевые, так и здоровые клетки, что негативно влияет на состояние организма. Поэтому ученые разрабатывают методы, позволяющие запустить окисление только в раковых клетках.
Ученые из Института теоретической и экспериментальной биофизики РАН (Пущино) и Саратовский национальный исследовательский университет имени Н.Г. . Чернышевского (Саратов) синтезировалиНаночастицы из оксида церия – биосовместимого соединения с большой способностью участвовать в окислительно-восстановительных реакциях. Оксид церия может защищать здоровые клетки от повреждений во время лучевой терапии, одновременно усиливая повреждения ДНК в раковых клетках. Исследователи стремятся повысить избирательность оксида церия, присоединив к нему пирролохинолинхинон – биоактивную молекулу, которая обладаетОбладает высоким антиоксидантным действием и участвует в регулировании работы митохондрий.
Учёные поместили наночастицы цериевого хлорида в раствор и прикрепили к ним молекулы пирролохинолинхинона. Полученные комплексы наносили на здоровые клетки соединительной ткани мыши – фибробласты, – а также на раковые клетки в разных концентрациях. Это помогло выяснить количества наночастиц, при которых не наблюдается массовой гибели клеток ни одного типа. В дальнейшем исследователи использовали именно эти концентрации для экспериментов с рентгеновским излучением.
Рентгеновские лучи уменьшили жизнеспособность фибробластов на 75%, а раковых клеток – на 32%. Обработка наночастицами и облучение повысили выживаемость здоровых фибробластов на 45% по сравнению с контрольными клетками, которые теряли жизнеспособность из-за естественных причин. У опухолевых клеток выживаемость снизилась на 31–37% по сравнению с контрольной группой – результат сопоставим с результатами облучения без наночастиц. Наночастицы практически не влияют на выживаемость нормальных клеток, но существенно снижают ее у раковых.
Избирательное токсичное воздействие по отношению к раковым клеткам обусловлено тем, что кислотность среды в них отличается от таковой у здоровых клеток. Из-за этого меняются свойства наночастиц, и под действием рентгеновских лучей наночастицы не проявляют такого же антиоксидантного эффекта.
Наблюдаемый эффект связан с тем, что наночастицы оксида церия, модифицированные пирролохинолинхиноном, уменьшают уровень активных форм кислорода в фибробластах и защищают их от окисления. Благодаря этому их можно использовать для защиты здоровых клеток от гибели при лучевой терапии рака. В дальнейшем планируется провести эксперименты на других типах здоровых и раковых клеток, чтобы понять механизм действия наночастиц в каждом случае. Руководитель проекта, поддержанного грантом РНФ, Нелли Попова, кандидат биологических наук и заведующий лаборатории изотопных исследований ИТЭБ РАН, рассказывает.
Российский научный фонд предоставил информацию и фотографии.