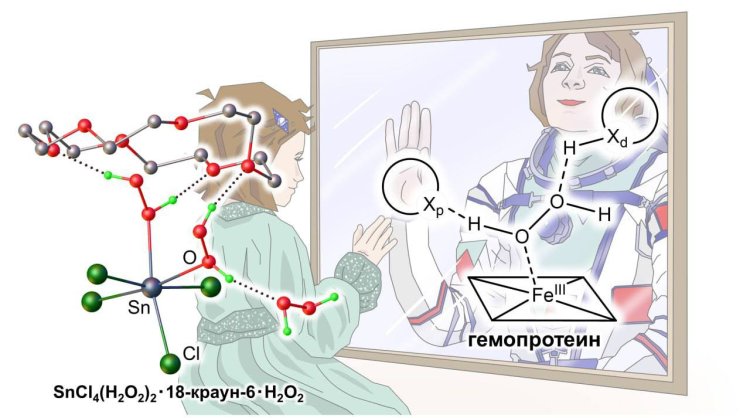
Схема. Фрагмент кристаллической структуры комплекса тетрахлорида олова с пероксидом водорода, стабилизированного молекулами краун-эфира. Автор иллюстрации: Екатерина Гуляева
Ученые из Института обшей и неорганической химии им. Н.С. Курнакова РАН, Института физической химии и электрохимии им. А.Н. Фрумкина РАН, Института элементоорганических соединений им. А.Н. Несмеянова РАН, Городского университета Гонконга и Еврейского университета в Иерусалиме предложили новый подход к получению комплексов пероксида водорода с металлом (олово), который состоит в том, что чистый безводный пероксид водорода используется и как лиганд, и как растворитель. Исследователи показали синергизм между координационной связью пероксида водорода с катионом металла и водородной связью, что может стать ключом к пониманию механизма химических превращений пероксида водорода в биологических системах. Результаты исследования, поддержанного грантом Российского научного фонда (№ 22-13-00426), опубликованы в журнале Nature Communications.
Пероксид водорода – природный метаболит, который постоянно образуется в клетках в качестве побочного продукта восстановления кислорода и выполняет ряд жизненно важных функций. Однако в высоких концентрациях пероксид водорода повреждает белки, что приводит к смерти клеток. Для обеспечения нормальной жизнедеятельности клеток большая часть пероксида водорода быстро выводится клетками как токсичные отходы. Для этого требуются специальные ферменты, которые активируют молекулу пероксида водорода за счет координации с металлоцентром, и далее пероксид водорода восстанавливается, превращаясь в воду. Для ряда гемопротеинов, в том числе пероксидаз, взаимодействие гема с пероксидом водорода, которое приводит к его восстановлению до воды, является их основной функцией. Однако молекулярный механизм этого взаимодействия пока не до конца ясен. Дело в том, что в молекуле пероксида водорода соседние электроотрицательные атомы кислорода взаимно ослабляют координирующие свойства друг друга, поэтому пероксид водорода – слабый лиганд и в равновесных условиях не образует комплексов с металлами в большинстве полярных растворителей, в том числе в водных растворах. До настоящего времени был получен лишь один кристаллический комплекс пероксида водорода, но и в этой структуре половина координированных с атомами цинка молекул пероксида водорода замещена на молекулы воды, поэтому в данной структуре не удалось локализовать позиции атомов водорода. Таким образом, важной задачей современной координационной химии является синтез и изучение комплексов металлов с пероксидом водорода.
Международный коллектив ученых из России, Израиля и Гонконга предложил новый подход к получению комплексов пероксид водорода – металл, который состоит в том, что чистый безводный пероксид водорода используется и как лиганд, и как растворитель. Для этого в Лаборатории пероксидных соединений и материалов на их основе ИОНХ РАН был разработан способ получения безводного 99.9% пероксида водорода.
Исследование прокомментировал заведующий лабораторией, доктор химических наук Петр Приходченко: «В качестве исходного вещества для взаимодействия с пероксидом водорода был выбран тетрахлорид олова, а для стабилизации и кристаллизации комплексов нами предложено использовать краун-эфир. Таким образом, удалось выделить два комплекса с пероксидом водорода и впервые для такого типа комплексов получить уникальные полные структурные данные с локализованными атомами водорода. Анализ структурных данных и квантово-химические расчеты показали наличие синергии между координационной связью атомов олова с молекулами пероксида водорода и водородными связями, которые образует пероксид водорода с молекулами краун-эфира. Водородные связи не только вносят вклад в общую энергию системы, но и усиливают координационную связь. Это объясняет, почему координация пероксида водорода, хотя и невозможна в водных растворах в равновесных условиях, широко распространена в природе. В пероксидазах расстояние от металлоцентра до протоноакцепторной группы (атома азота гистидина) составляет 5.7 ангстрем, что слишком велико для активации воды, но подходит для активации пероксида водорода. Таким образом, водородная связь Fe-O(H)-OH···N стабилизирует координацию пероксида водорода с атомом железа гемопротеина.
Ранее предполагалось, что координация с атомом металла является ключевым фактором активации пероксида водорода при окислении органических соединений. Данное исследование показало, что водородная связь второй координационной сферы играет ключевую роль в стабилизации координации пероксида водорода. По словам авторов, представленная работа открывает перспективы разработки новых каталитических систем, дизайн которых позволил бы использовать синергию координационной и водородной связи и обеспечить координацию и активацию пероксида водорода в присутствии воды или других полярных молекул.
Источник: Medvedev, A.G., Egorov, P.A., Mikhaylov, A.A. et al. Synergism of primary and secondary interactions in a crystalline hydrogen peroxide complex with tin. Nat Commun 15, 5758 (2024). https://doi.org/10.1038/s41467-024-50164-9
Информация и иллюстрация предоставлены Институтом общей и неорганической химии им. Н.С. Курнакова
