
Сегодня до преклонного возраста доживает больше людей, чем когда-либо прежде. Средняя продолжительность жизни растет во всем мире. Казалось бы, тенденция позитивная. Но вместе с тем растет и количество хронических заболеваний, которые преследуют пожилых людей. Современной медицине все лучше удается лечить и сдерживать развитие многих серьезных заболеваний. Но все же остаются некоторые возрастные проблемы, для которых пока не существует ни методов профилактики, ни способов лечения. Самая известная среди них — болезнь Альцгеймера. Это заболевание постепенно отбирает у человека память и чувство самоидентичности, разрушая жизнь самого пациента и его близких. О том, какие биологические механизмы стоят за развитием заболевания и ждать ли в обозримом будущем лекарства — наш разговор с Владимиром Митькевичем.
Владимир Александрович Митькевич — член-корреспондент РАН, доктор биологических наук, заместитель директора по научной работе Института молекулярной биологии им. В.А. Энгельгардта РАН.
— Прошло более 100 лет с тех пор, как Алоис Альцгеймер впервые выступил с описанием нейродегенеративного заболевания, которое было названо его именем. Но до сих пор у нас нет способа противостоять этому недугу и излечиться. Почему?
— Действительно, болезнь Альцгеймера была описана более 100 лет назад. И в настоящее время диагностика болезни Альцгеймера приобретает все большее значение, поскольку это заболевание поражает в основном людей престарелого возраста. При этом средняя продолжительность жизни человека постепенно растет, а значит, и людей с нейродегенеративными заболеваниями типа болезни Альцгеймера становится все больше.
Вместе с тем ежегодно увеличивается и количество научных коллективов, которые исследуют болезнь Альцгеймера. Ученые пытаются описать механизмы и причины развития заболевания и, конечно, найти лекарство или способы лечения. Но сегодня решения пока нет.
Если говорить о механизмах, то основная сложность состоит в том, что болезнь Альцгеймера — заболевание многопараметрическое. То есть множество различных факторов могут вызывать развитие патологии. И определить, какая из этих причин главная, довольно сложно. В данном случае речь идет о спорадической форме болезни Альцгеймера.
Но существует также наследственная форма заболевания, механизмы развития которой связаны с наследственными мутациями в белке, известном как бета-амилоид. Среди известных мутаций есть и те, которые вызывают болезнь Альцгеймера достаточно рано. У некоторых людей первые симптомы заболевания могут проявляться в 50–55 лет.
Часто мутации бета-амилоида вызывают его усиленную агрегацию, запуская патологический каскад болезни Альцгеймера. Но известно также и о других белках, которые могут быть ответственны за развитие патологии. Например, есть такой белок АроЕ, который вовлечен в липидный обмен. Установлено, что одну из форм этого белка, АроЕ-4, можно считать плохим прогностическим признаком болезни Альцгеймера. То есть люди с формой белка АроЕ-4 с большой вероятностью могут заболеть болезнью Альцгеймера в будущем.
Надо сказать, что в отношении белка АроЕ-4 достигнут некий прогресс в лечении. Буквально недавно появились сведения о первой фазе клинических испытаний геннотерапевтического препарата, который индуцируют экспрессию АроЕ-2 — защитной формы белка АроЕ, которая уменьшает вероятность развития болезни Альцгеймера. Как оказалось, внедрение формы АроЕ-2 в организм человека с подтвержденной деменцией замедляет развитие некоторых симптомов. Конечно, пока речь идет о нескольких пациентах. Посмотрим, какими будут результаты дальнейших исследований.
Что же касается спорадических форм болезни Альцгеймера, то здесь нам пока мало что известно. С уверенностью можно говорить лишь о том, что бета-амилоид из нормальной, физиологически необходимой молекулы превращается в некую патологическую форму и начинает образовывать олигомеры, которые распространяются по организму и формируют амилоидные бляшки в тканях мозга. Помимо этого, развивается так называемая тау-патология. То есть гиперфосфорилирование внутриклеточного белка тау приводит к его слипанию и образованию нейрофибриллярных клубков, которые накапливаются в тканях мозга и приводят к нейровоспалению. Описанные механизмы обязательно сопровождают болезнь Альцгеймера. Но что запускает этот процесс — загадка.
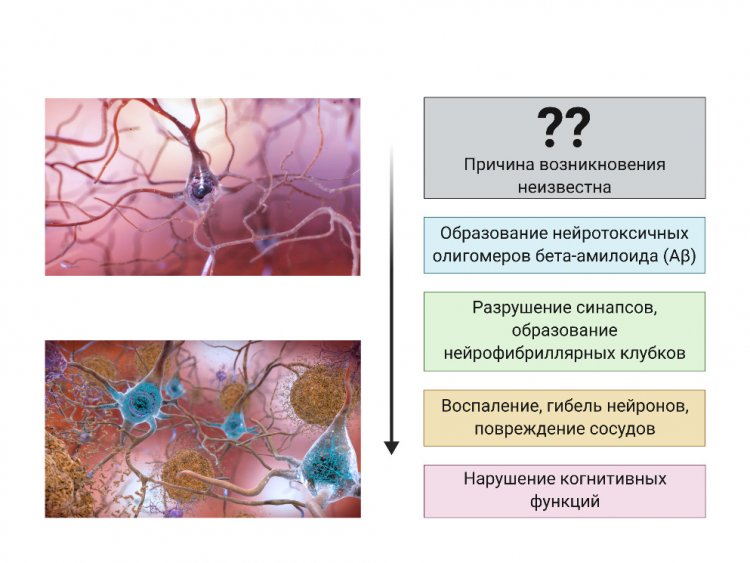
Этапы развития патологического процесса при болезни Альцгеймера. Автор: В.А. Митькевич. Предоставлено В.А. Митькевичем
Наш коллектив, решая эту задачу, сосредоточился на изоформах бета-амилоида. Дело в том, что кроме наследственных мутаций в бета-амилоиде сама молекула белка может претерпевать посттрансляционные модификации. Проще говоря, в белке могут происходить изменения уже после того, как он образовался. И одна из таких модификаций — изомеризация аспарагиновой кислоты 7.
При изомеризации происходит удлинение белковой цепи на одну связь. Тем самым меняются и свойства белка — он оказывает токсичное действие на нейрональные клетки. Изомеризованный бета-амилоид в нейрональных клетках вызывает индукцию гиперфосфорилирования белка тау. Такой изомеризованный бета-амилоид активнее создает патогенные олигомеры и агрегаты в комплексах с ионами цинка.
— Какова роль цинка в этом процессе?
— Цинк считается одним из факторов, провоцирующих болезнь Альцгеймера. Бета-амилоид образует комплекс с ионами цинка, что вызывает сильную агрегацию бета-амилоида.
Мы проводили исследования на лабораторных мышах. При введении изомеризованного бета-амилоида усиливается образование амилоидных бляшек. При этом если мы вводим обычный бета-амилоид, никакого усиления не наблюдается. Таким образом мы доказали патогенную природу изомеризации бета-амилоида.
Мы провели также исследования на нематодах Caenorhabditis elegans. Это излюбленный объект биологов, поскольку нематоды живут очень недолго, в пределах трех недель. За это время можно получить конкретный результат, которого в случае с мышами пришлось бы ждать год или два.
Caenorhabditis elegans. Автор: Kbradnam / Zeynep F. Altun. Источник: Wikipedia
Так вот, трансгенных нематод, продуцирующих человеческий бета-амилоид, мы обрабатывали изомеризованным бета-амилоидом и изомеризованным бета-амилоидом в комплексе с ионами цинка. Оказалось, что именно в комплексе с цинком изомеризованный бета-амилоид вызывает патологическую агрегацию собственного амилоида нематод. Таким образом была доказана роль комплекса изомеризованного бета-амилоида с цинком в патологических процессах, ассоциированных с развитием болезни Альцгеймера.
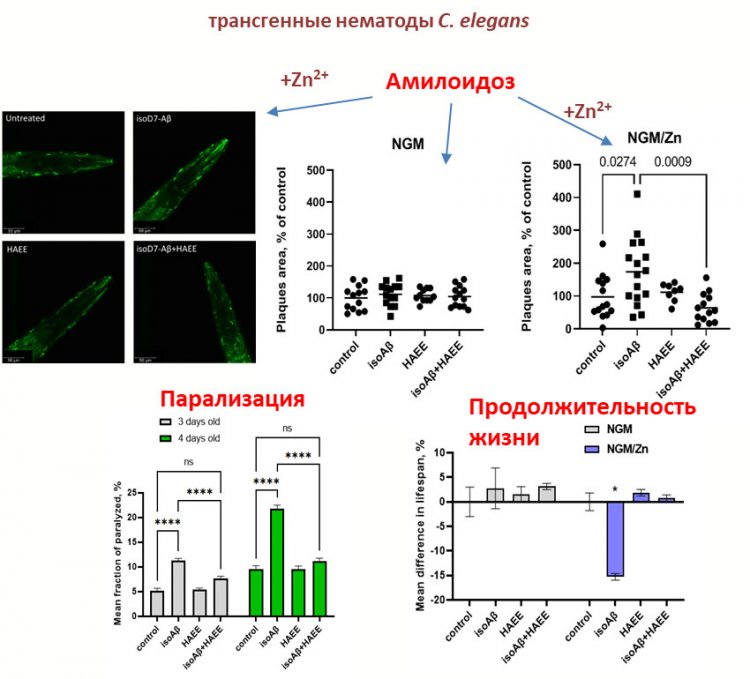
Влияние изомеризованного по остатку Asp7 бета-амилоида (isoAβ) и тетрапаптида HAEE в присутствии Zn2+ на амилоидную нагрузку у C. elegans. NGM — среда роста нематод. Автор: В.А. Митькевич. Предоставлено В.А. Митькевичем
В то же время мы использовали четырехчленный пептид, который в свое время был разработан для предотвращения агрегации бета-амилоида. Так вот, с использованием этого четырехчленного пептида мы смогли полностью предотвратить развитие агрегации белка в присутствии изомеризованного амилоида с цинком. И эта группа нематод вела себя так же, как и нематоды из контрольной группы. Поэтому, с нашей точки зрения, одна из движущих сил амилоидогенеза — это именно изомеризация бета-амилоида.
— В чем причина подобной изомеризации?
— Начну с того, что амилоидные бляшки состоят из бета-амилоида и ионов двухвалентных металлов, в том числе цинка, железа. Анализ показал, что изомеризованный бета-амилоид может составлять до 70% всего амилоида в бляшках. В свое время считалось, что изомеризация происходит спонтанно ввиду того, что амилоидные бляшки могут находится в организме десятки лет. Благодаря работе на модельных животных мы показали, что процесс изомеризации имеет накопительный характер в бета-амилоиде.
Но важнее то, как начинается агрегация бета-амилоида. Очевидно, что должен быть какой-то триггерный механизм для запуска такого процесса. Ведь в целом бета-амилоид — это нормальная молекула, которая играет существенную роль в нейрогенезе. Так, например, нокаутные по бета-амилоиду животные, то есть те организмы, у которых намеренно удален данный белок, умирают через неделю после рождения, поскольку у них не образуются нервные связи. Бета-амилоид может участвовать также в защите от патогенов и в репарации повреждений гематоэнцефалического барьера.
Следует отметить и то, что бета-амилоид — очень консервативная молекула. Этот белок существовал практически в неизменном виде около 500 млн лет назад. Исследуя бета-амилоид, мы обнаружили, что его отложения накапливаются в основном в синаптической щели, в месте, где происходит передача сигнала от одного синапса к другому. Здесь также возможно увеличение концентрации цинка до очень больших значений.
Если предположить, что одновременно что-то задержало бета-амилоид или привело к его накоплению в большом количестве в синаптической щели и при этом увеличилась концентрация цинка, то возможно образование зародышей агрегации. Такие зародыши становятся матрицей для накопления бета-амилоида, тем самым запуская агрегационный процесс.
Амилоидные бляшки нестабильны, они могут распадаться на небольшие олигомеры. И образование вторичных олигомеров уже стмулирует общий процесс распространения бета-амилоида, что приводит к развитию болезни Альцгеймера.
— Разве иммунная система не должна распознавать амилоидные агрегаты как чужеродное образование и бороться с ними?
— Действительно, так и происходит. Есть специализированные клетки в мозге, в первую очередь клетки микроглии, которые поглощают агрегаты бета-амилоида. Существует предположение, что при постоянной агрегации бета-амилоида микроглия «переедает» и в какой-то момент ее буквально разрывает, а на ее месте образуется амилоидная бляшка.
Есть даже теория, вполне обоснованная, о том, что бляшки на самом деле вбирают в себя излишки бета-амилоида. Ведь они не сильно сказываются на организме. Человек или животное может жить с этими бляшками достаточно продолжительное время, никак не замечая их наличия. Поэтому считается, что основное негативное влияние оказывают растворимые олигомерные формы бета-амилоида.
— Немного о поиске лекарства. Несколько лет назад немало шума наделал препарат адуканумаб. Что не получилось у американских коллег?
— Отмечу, что способы лечения болезни Альцгеймера с помощью моноклональных антител стали исследовать задолго до появления адуканумаба. Однако все клинические испытания потерпели неудачу намного раньше. Несколько лет назад было получено разрешение на ограниченное использование этого препарата. FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. — Примеч. НР) выдала разрешение, но с оговорками, что необходимо провести дальнейшее исследование. Тогда препарат стали быстро внедрять в клиническую практику, несмотря на то что у некоторых пациентов развивались побочные эффекты, например отек мозга. Видимо, регулятор посчитал, что пользы от препарата больше, чем вреда.
Насколько я знаю, дальнейшие исследования в ходе применения показали, что побочных эффектов гораздо больше. К тому же эффективность препарата, прямо скажем, не впечатляет. Речь идет скорее о замедлении болезни в пределах 10–15%.

Владимир Митькевич и корреспондент портала Анастасия Рогачева. Фото: Елена Либрик / «Научная Россия»
В начале этого года (2023) FDA одобрило еще одно моноклональное антитело — леканемаб, против растворимых протофибрилл бета-амилоида. Заявленная эффективность этого препарата немного выше, чем у адуканумаба.
Подчеркну, что сейчас ведется поиск препаратов, которые будут способны восстановить регуляцию бета-амилоида, поскольку лекарства для замедления симптомов болезни Альцгеймера на самом деле существуют.
— А чего удалось достичь в сфере диагностики заболевания?
— Действительно, без качественной диагностики мы не сможем эффективно лечить болезнь. Сложность в том, что симптомы проявляются тогда, когда когнитивные функции пациентов уже нарушены, а лечить болезнь по сути поздно. Речь идет о дегенерации нейронов и повреждении нервной ткани, восстановить которую практически невозможно.
Поэтому, конечно, нужна полноценная профилактика. Нужны способы диагностики, которые рассчитаны на определение признаков заболевания, патологических молекул на очень ранних стадиях. Болезнь Альцгеймера может развиваться 10–20 лет. Поэтому диагностировать предсимптомную стадию необходимо за пять-десять лет до появления внешних симптомов.
Сегодня существуют способы измерения уровня бета-амилоида и гиперфосфорилированного тау в спинномозговой жидкости. Ведутся также разработки в области анализа крови. С нашими коллегами из Института биохимической физики им. Н.М. Эмануэля РАН мы работаем с панелью маркеров заболевания в крови. Это белковые маркеры, которые получены от пациентов с различными стадиями болезни Альцгеймера и от здоровых людей контрольной группы. Предварительно выделена группа белков, по которым можно анализировать симптоматику болезни Альцгеймера еще на доклинической стадии. Возможно, в скором времени мы получим работающий метод диагностики предсимптомных стадий этого заболевания. Большой прогресс в данной сфере наблюдается у японских коллег. К тому же кровь сегодня — самый распространенный способ получения биоматериала от пациента.
— И легкий в отличие от забора спинномозговой жидкости.
— Да, забор спинномозговой жидкости — это, в общем-то, болезненная процедура, к тому же достаточно дорогостоящая. И если мы сможем получить диагностику, основанную на крови, это, безусловно, упростит и сделает доступными подобные анализы.
— А в случае наследственного влияния можно ли проверить гены?
— Да, конечно, соответствующие панели уже существуют и применяются.
— Наследственность — это не только гены, но и влияние среды. Если человек узнал, что у него есть предрасположенность, как он может себя обезопасить?
— Сложный вопрос. Здесь мы сталкиваемся с этической проблемой. Как сказать человеку, что в будущем у него может развиться заболевание, лекарства от которого не существует? Остается надеяться, что в обозримом будущем ученые смогут найти лекарство. Как и всегда, здоровый образ жизни будет способствовать уменьшению вероятности развития заболевания. Очень важно тренировать мозг, развивать память.
— Оценивая современный уровень исследований и поиск лекарства, как вы считаете, когда человечество сможет победить болезнь Альцгеймера?
— Прогнозы — вещь неблагодарная. Но могу сказать, что мы подошли к моменту, когда количество должно переходить в качество. На мой взгляд, в области диагностики научное сообщество должно достигнуть прогресса уже в ближайшие три-четыре года. Думаю, что уже скоро появятся эффективные способы диагностирования за несколько лет до развития патологии.
Уверен, что будут совершенствоваться способы установления генетических маркеров кроме упомянутого АроЕ. Уже сегодня рассматриваются некоторые гены-кандидаты, изменения в которых могут служить прогностическим признаком.
В области лечения, конечно, быстрых результатов ожидать не следует, поскольку эффективно лечить можно лишь на ранних стадиях, которые сегодня определить довольно сложно. Поэтому, как только появятся способы достоверной диагностики на ранних стадиях, начнутся попытки применять кандидатные препараты.
Хотя, возможно, что-то сработает намного раньше. Сейчас ведутся разработки препаратов, которые смогут бороться с растворимыми формами бета-амилоида. Усилий на самом деле много, и хорошие результаты уже есть во всем мире. Мы все ближе подбираемся к способам эффективного замедления развития патологии и, возможно, к полному восстановлению когнитивных функций.
Интервью проведено при поддержке Министерства науки и высшего образования РФ и Российской академии наук.
